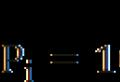Konstanter av Antoine-ligningen for bensin. Antoine-korrelasjon for damptrykk
Jeg lagde en gang pannekaker i en gruppe kamerater, hvor det var tetotalere med magesår. Jeg lyver, det så ikke ut til å være noen sår, men teetotalers var spesielle. Noen nektet blankt å konsumere etylalkohol i noen form, selv i form av kefir. Og argumenter som det faktum at menneskekroppen selv produserer alkohol i en viss mengde gikk ikke gjennom. Det produserer, ja, men dette er en ubevisst (les irrasjonell) prosess, og vi, som legemliggjøringen av rasjonalitet, ønsker ikke å legge til det vi ikke ønsker å legge til.
Ja, jeg glemte å si, jeg ønsket å lage pannekaker ikke med noe, men med ekte øl - 5% av dette av etylalkohol.
Jeg måtte tenke på andre rasjonelle argumenter.
Det var nødvendig å på en eller annen måte demonstrere (les bevise) fraværet av alkohol i det ferdige produktet.
Vel, la oss huske ungdommen vår.
Massen til et stoff fordampet fra enhver overflate beregnes ved hjelp av formelen (vi husker dette; og alt er logisk):
m = W * S * t, hvor
W - fordampningsintensitet,
S - overflate i m²,
t - tid i s.
Vi kjenner massen (bortsett fra tetthet): 0,5 kg 5 % - 25 g = 0,025 kg alkohol. Men dette er i hele pannekakemassen. Med tanke på at fra volumet av deig som går inn i en flaske øl, planla jeg å få ca 40 pannekaker, noe som betyr at en pannekake står for ~0,000625 kg alkohol. Litt. Men digitale teknologier krever argumenter bare i form av tall, noen ganger nedlatende til grafer og diagrammer. Ok. La oss fortsette.
Vi kjenner også området til fordampningsoverflaten - la oss ta det som arealet av pannekaken (dvs. stekepanne 22cm = 0,22m) = π*0,22² ~ 0,1521 m²
Nå må du finne ut hvor raskt alkoholen fordamper.
Her måtte jeg gå til Internett, som rapporterte at fordampningshastigheten er beregnet som
W = 10⁻⁶ * n * √m * P,
hvor n er en koeffisient som tar hensyn til hastigheten på omgivelsesluftstrømmen (tatt fra tabellene). I dette tilfellet bestemte jeg meg for å ignorere det, i betydningen å ta det som 1 (dvs. flyt = 0 m/s).
m er molekylvekten til stoffet. Å, det er lett nok. C₂H₅OH - 46,07 g/mol (Internett hjalp oss her).
Men P er det mettede damptrykket til et stoff ved en bestemt temperatur og beregnes ved å bruke Antoines ligning
logP = A-B/(C+T), der T er designtemperaturen, og A, B, C er konstantene til Antoine-ligningen for avhengigheten av mettet damptrykk på temperaturen.
Yoprsh. Vanlige mennesker tar slike verdier fra oppslagsverk, men heldigvis hadde jeg ikke noe passende for hånden. Og Internett, infeksjonen, var stille. Jeg stilte tydeligvis feil spørsmål i parken...
Men... steketemperaturen til pannekaker er klart høyere enn kokepunktet til alkohol (for ikke å forvirre hvem av dem som gjør hva), og dette kan ikke bety noe annet enn at trykket til det fordampede stoffet er lik det ytre trykket , dvs. la Antoine nervøst røyke på sidelinjen, vil vi ta dataene for standard atmosfærisk trykk - 100 kPa.
Så alle de første dataene er der. Vi teller:
B = 10⁻⁶ * 1* √46,07 * 100 = 0,00068 kg/m²s
t = 0,000625 / (0,00068 * 0,1521) = 6,04 s
Skjønner. All alkoholen vil fordampe fra pannekaken på mindre enn 10 sekunder.
Avgangsmennene måtte sjekke beregningene og beklage feilen i metoden som ble brukt (den kjemiske aktiviteten til stoffet ble ikke tatt i betraktning og beregningene ble angivelig utført for et rent stoff osv.), men de spiste likevel pannekakene . Q.E.D!
Konstruksjon av et faselikevektsdiagram av en binær blanding
1. Innhold i oppgaven:
Formulering av problemet:
Ved trykk P, konstruer et faselikevektsdiagram for en gitt 2-komponent blanding ved å bruke følgende modeller: a) ideell blanding; b) Wilson; c) NRTL.
Gitt:
P, stoffer.
Bygge:
Jeg planlegger: T = f (x A); T = f (y A) – antall poeng N = 101 av blandingen i henhold til modellene: a) ideell blanding; b) Wilson; c) NRTL.
II tidsplan: y A = f (x A) – antall poeng N = 101. blandinger i henhold til modeller: a) ideell blanding; b) Wilson; c) NRTL.
Oppgavealternativer:
|
Komponenter |
Komponenter |
||||||
Legende:
EN- svært flyktig komponent;
B- lavflyktig komponent;
x i– innhold av den i-te komponenten i væskefasen, (mol.%);
y jeg– innhold av den i-te komponenten i dampfasen, (mol.%);
Jeg– komponentindeks;
k i– faselikevektskonstant for den i-te komponenten;
P– trykk i systemet, ata;
P i– damptrykk over et rent løsemiddel, ata;
T– systemtemperatur, °C
T balleJeg– kokepunktet for den i-te komponenten, °C
γ – aktivitetskoeffisient
Λ ij, V i, λ ij– parametere til Wilson-modellen;
G ij, g ij– parametere for NRLT-modellen;
Matematisk modell:
Støkiometrisk forhold:
∑x i = 1; ∑y jeg = 1
Faselikevekt:
Faselikevektskonstant:
Mettet damptrykk av den i-te komponenten:
![]()
Aktivitetskoeffisienter:
a) perfekt blanding
b) ifølge Wilson
Merk: overskriften er en firkant.
Referansedata:
Antoine ligningskoeffisient
V1 = 104,00; V2 = 49,60; V3 = 18,70
a12 = 0,30; a13 = 0,20; a23 = 0,46
Beregningsalgoritme ved hjelp av den ideelle blandingsmodellen:
1. Skriv ned koeffisientene ENJeg,B jeg,C i Antoines ligninger for et gitt stoffpar.
2. Finn kokepunktene til stoffer i henhold til "kokepunktsøkealgoritmen" T balle ved et gitt systemtrykk P” og bestemme fra et par stoffer det svært flyktige stoffet A og det svært flyktige stoffet B.
3. Finn temperaturtrinnet

4. Vi finner T j på j = 1, … , N.
T 1 =T HTj +1 =T j+Δ T
5. For alle T j Vi finner P A Og P B ifølge Antoines ligning.
6. For alle T j Vi finner K A Og K B på γ = 1.
7. For alle T j Vi finner x A

8. For alle T j Vi finner y A.
9. Vi bygger grafer.
Beregningsalgoritme ved hjelp av Wilson ogNRLT:
punktene 1-7 er de samme som i "beregningsalgoritmen ved bruk av den ideelle blandingsmodellen"
8. For x 1 =x A Og x 2 = 1 –x A finn de naturlige logaritmene til aktivitetskoeffisientene ln γ 1 og ln γ 2 i henhold til Wilson-modellen eller NRLT.
9. Finne aktivitetskoeffisienter γ 1 Og γ 2 i henhold til Wilson-modellen eller NRLT.
10. For alle T j Vi finner K A Og K B på γ 1 Og γ 2, beregnet i paragraf 9.
11. For alle T j la oss avklare x A

12. For alle T j Vi finner y A.
13. Vi bygger grafer.
KokepunktsøkealgoritmeT balle ved systemtrykkP:
1. Still inn en egendefinert temperatur T.
2. Finn P i av et gitt stoff ved en gitt temperatur T ifølge Antoines ligning.
3. Hvis | P i – P|< 0,001, da T balle = T. Hvis | P i – P| ≥ 0,001, gå deretter til trinn 1, velg T til betingelsen i trinn 3 er oppfylt.
2. Innhold i rapporten:
Formulering av problemet
Målet med arbeidet
Fremdrift av arbeidet, med en beskrivelse av beregninger, hvis resultater presenteres i form av grafer;
3. Spørsmål for kontroll:
1) Hovedstadiene i å konstruere en matematisk beskrivelse av masseoverføringsprosesser. Hva er den matematiske beskrivelsen av masseoverføringsprosessen basert på?
2) Fysisk betydning av faselikevektsdiagrammet. Heterogene og homogene systemer. Faselikevektsdiagrammers avhengighet av trykk.
3) Fugasiteten til komponenten i blandingen, aktivitetskoeffisienten til komponenten.
4) Wilsons ligning (begrepet lokale komposisjoner). NRTL-ligning (2 celletyper).
Clapeyrons ligning
Ved integrering av Clausius-Clapeyron-ligningen antas det i enkleste tilfelle at gruppen har en konstant verdi som ikke er avhengig av temperatur.
Ved å angi den konstante verdien av integrasjon med "A", får vi
Relasjon (7,5) kalles noen ganger Clapeyron-ligningen. Grafisk uttrykkes den gitte avhengigheten med en rett linje. Ofte viser likning (7.5) seg å være en god tilnærming, men i det generelle tilfellet gir den betydelige feil på grunn av at avhengigheten av har S-formet utseende. Ligning (7.5) er ikke anvendelig for temperaturer under det normale kokepunktet, selv for ikke-polare stoffer som ikke er utsatt for dannelse av assosiasjoner. For sistnevnte, den lineære formen P-T avhengigheter kan brukes til å tilnærme P-T data bare i et smalt temperaturområde, selv i temperaturområdet over det normale kokepunktet.
Antoine-korrelasjon for damptrykk
Antoine foreslo en mye brukt enkel modifikasjon av ligningen (7.5):
Ved C=0 blir ligning (7.6) til Clapeyron-ligning (7.5). Konstantene "A", "B" og "C" i Antoines ligning oppnås ved å tilnærme eksperimentelle P-T data. For mange stoffer er verdiene til disse konstantene gitt i referanselitteratur. Anvendeligheten av Antoine-likningskonstantene er begrenset til de temperatur- eller trykkområdene de er anbefalt for av forfatterne av disse oppslagsbøkene. Antoines ligning kan ikke brukes utenfor de anbefalte intervallene.
Cox-Antoine korrelasjon for damptrykk
Cox foreslo en grafisk korrelasjon av damptrykk. På grafen er logaritmen plottet langs ordinataksen og en rett linje (med en positiv helning) tegnes, hvis ordinater tilsvarer verdiene av damptrykket til vann (eller et annet referansestoff). Siden vanndamptrykkets avhengighet av temperaturen er velkjent, er abscissen derfor markert i temperaturenheter. På koordinatfeltet utarbeidet på denne måten vil damptrykkene til andre stoffer også være avbildet med rette linjer. Slike grafer er imidlertid noe upraktiske for praktisk bruk på grunn av det faktum at interpolering etter temperatur viser seg å være svært unøyaktig.
Kalingert og Davis viste at temperaturskalaen oppnådd på denne måten er nesten ekvivalent med en funksjon; her er "C" omtrent lik 43 K for de fleste stoffer som koker ved temperaturer fra 0 til 100 C. De samme forfatterne konstruerte avhengighetene til damptrykk for en rekke stoffer ved å bruke den angitte metoden og oppnådde nesten rette linjer. Ligningen deres
veldig lik Antoine-ligningen, den kalles ofte akkurat det, og dens grafiske representasjon regnes som et Cox-diagram.
I litteraturen kan du finne indikasjoner på at det er ganske enkle regler som forbinder konstanten "C" med det normale kokepunktet til et stoff. Selv om disse reglene ikke er veldig pålitelige, er noen av dem gitt nedenfor som en introduksjon til tilnærmingene.
Thompsons regler:
· for monoatomiske og alle stoffer med normalt kokepunkt K
· for andre tilkoblinger
· for stoffer hvis normale kokepunkt er over 250 K, anbefales det å ta C = 43 K;
· for lavtkokende gasser C 0.
En annen, mer vanlig form for Cox-Antoine-korrelasjon oppnås ved å differensiere ligning (7.7) med hensyn til 1/T og kombinere det resulterende forholdet med Clausius-Clapeyron-ligningen (7.3). For det normale kokepunktet er konstantene "A" og "B" uttrykt i dette tilfellet som følger:
Hvor P vp uttrykt i fysiske atmosfærer.
For å bruke ligninger (7.8), trenger du bare å vite på T b Og T b. . I samsvar med Millers anbefaling kan ~ 1,05 tas for de fleste stoffer i lavtrykksregionen.